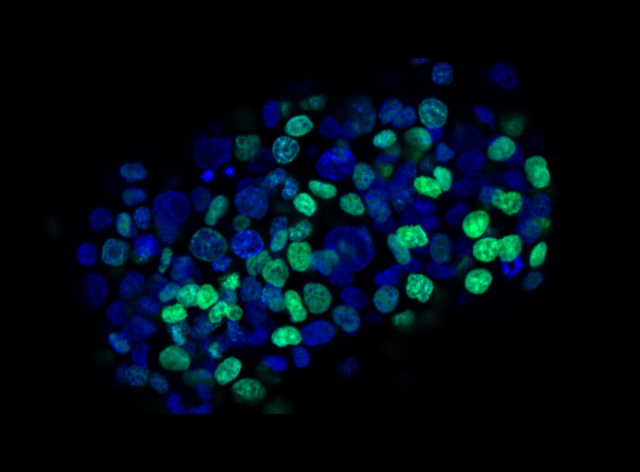
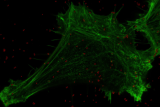
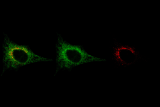
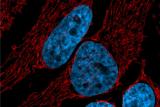
Au sein de notre groupe de recherche TumHyp, nous investiguons les mécanismes moléculaires de la résistance des cellules cancéreuses aux chimio-, radio- et immuno-thérapies.
Promotrice (PI) | Carine Michiels
Carine Michiels est professeur ordinaire à l'Université de Namur et membre de l'Institut Narilis.
Voir le profil de Carine Michiels dans l'annuaire de l'UNamur.

La recherche au sein du groupe TumHyp
Le groupe de recherche TumHyp étudie les mécanismes de progression tumorale et de résistance aux chimiothérapies, radiothérapies et immunothérapies, dans le but de développer de nouvelles stratégies pour surmonter la résistance au traitement ou la récidive. Dans ce contexte, l'effet de plusieurs mécanismes physiques et cellulaires de résistance et d'invasivité est étudié, tels que l'hypoxie tumorale, la mort cellulaire, la sénescence, l'inflammation et l'interaction des cellules cancéreuses avec le microenvironnement tumoral.
De nombreuses études ont abordé la question de savoir comment surmonter la résistance intrinsèque ou acquise des cellules cancéreuses à la radiothérapie. Dans ce contexte, les recherches actuelles visent à identifier les gènes impliqués dans la résistance intrinsèque à la radiothérapie du glioblastome. En outre, l'induction de la mort cellulaire, de la sénescence et de l'arrêt du cycle cellulaire après un traitement par radiothérapie fait l'objet d'études dans les cancers de la tête et du cou, du pancréas et du poumon. L'utilisation de la radiothérapie par particules chargées, seule ou en combinaison avec des nanoparticules d'or ou une immunothérapie, pour potentialiser la destruction des cellules cancéreuses, la létalité synthétique ou pour favoriser un microenvironnement tumoral inflammatoire et une réponse immunologique antitumorale, présente un intérêt particulier.
Programmes de recherche actuels
- Étude de la résistance du glioblastome au témozolomide associé à la radiothérapie (rayons X vs protons) : rôle des vésicules extracellulaires
- Décryptage de l'interaction dynamique entre la sénescence du microenvironnement induite par l'irradiation et le développement tumoral dans le contexte du sarcome des tissus mous
- Immunogénicité des cellules cancéreuses induite par la radiothérapie
- Développement d'une thérapie personnalisée de capture neutronique à l'aide de vecteurs théranostiques
- Détermination des gènes impliqués dans la résistance intrinsèque au temozolomide combine à la protonthérapie pour le traitement des glioblastomes
- Étude de la réponse pro-sénescente en réponse aux traitements anticancéreux dans le cadre des cancers tête et cou HPV positif vs HPV négatif
- Etude de l’effet radiosensibilisation de nanoparticules d’or
- Modulation de l'immunosuppression tumorale par protonthérapie afin de renforcer les effets du bloqueur de point de contrôle immunitaire PD-1
- Etude in vitro et in vivo les effets de la protonthérapie FLASH: de la ferroptose, du stress oxydatif et de la sénescence aux stress du RE et de la mitochondrie”
Nos publications
The oxygen puzzle in FLASH radiotherapy: A comprehensive review and experimental outlook. Scarmelotto A, Delprat V, Michiels C, Lucas S, Heuskin AC. Clin Transl Radiat Oncol. 2024 Sep 18;49:100860.
doi: 10.1016/j.ctro.2024.100860. eCollection 2024 Nov. PMID: 39381632 Free PMC article.
Indacaterol inhibits collective cell migration and IGDQ-mediated single cell migration in metastatic breast cancer MDA-MB-231 cells. Ayama-Canden S, Tondo R, Pineros Leyton ML, Ninane N, Demazy C, Dieu M, Fattaccioli A, Sauvage A, Tabarrant T, Lucas S, Bonifazi D, Michiels C. Cell Commun Signal. 2023 Oct 30;21(1):301.
doi: 10.1186/s12964-023-01340-9. PMID: 37904233 Free PMC article.
IGDQ motogenic peptide gradient induces directional cell migration through integrin (αv)β3 activation in MDA-MB-231 metastatic breast cancer cells. Ayama-Canden S, Tondo R, Piñeros L, Ninane N, Demazy C, Dieu M, Fattaccioli A, Tabarrant T, Lucas S, Bonifazi D, Michiels C. Neoplasia. 2022 Sep;31:100816.
doi: 10.1016/j.neo.2022.100816. Epub 2022 Jun 25. PMID: 35763908 Free PMC article.
Taking Advantage of the Senescence-Promoting Effect of Olaparib after X-ray and Proton Irradiation Using the Senolytic Drug, ABT-263. Huart C, Fransolet M, Demazy C, Le Calvé B, Lucas S, Michiels C, Wéra AC. Cancers (Basel). 2022 Mar 12;14(6):1460.
doi: 10.3390/cancers14061460. PMID: 35326611 Free PMC article.
The impact of macrophages on endothelial cells is potentiated by cycling hypoxia: Enhanced tumor inflammation and metastasis. Delprat V, Huart C, Feron O, Soncin F, Michiels C. Front Oncol. 2022 Sep 28;12:961753.
doi: 10.3389/fonc.2022.961753. eCollection 2022. PMID: 36248978 Free PMC article.
Gold nanoparticles meet medical radionuclides. Daems N, Michiels C, Lucas S, Baatout S, Aerts A. Nucl Med Biol. 2021 Sep-Oct;100-101:61-90.
doi: 10.1016/j.nucmedbio.2021.06.001. Epub 2021 Jun 15. PMID: 34237502 Free article.
A bi-directional dialog between vascular cells and monocytes/macrophages regulates tumor progression. Delprat V, Michiels C. Cancer Metastasis Rev. 2021 Jun;40(2):477-500.
doi: 10.1007/s10555-021-09958-2. Epub 2021 Mar 30. PMID: 33783686 Free PMC article.
Could Protons and Carbon Ions Be the Silver Bullets Against Pancreatic Cancer? Huart C, Chen JW, Le Calvé B, Michiels C, Wéra AC. Int J Mol Sci. 2020 Jul 4;21(13):4767.
doi: 10.3390/ijms21134767. PMID: 32635552 Free PMC article.
Gold Nanoparticles as a Potent Radiosensitizer: A Transdisciplinary Approach from Physics to Patient. Penninckx S, Heuskin AC, Michiels C, Lucas S. Cancers (Basel). 2020 Jul 23;12(8):2021.
doi: 10.3390/cancers12082021. PMID: 32718058 Free PMC article.
Cycling hypoxia promotes a pro-inflammatory phenotype in macrophages via JNK/p65 signaling pathway. Delprat V, Tellier C, Demazy C, Raes M, Feron O, Michiels C. Sci Rep. 2020 Jan 21;10(1):882.
doi: 10.1038/s41598-020-57677-5. PMID: 31964911 Free PMC article.
Antibody-functionalized gold nanoparticles as tumor-targeting radiosensitizers for proton therapy. Li S, Bouchy S, Penninckx S, Marega R, Fichera O, Gallez B, Feron O, Martinive P, Heuskin AC, Michiels C, Lucas S. Nanomedicine (Lond). 2019 Feb;14(3):317-333.
doi: 10.2217/nnm-2018-0161. Epub 2019 Jan 24. PMID: 30675822
Thioredoxin Reductase Activity Predicts Gold Nanoparticle Radiosensitization Effect. Penninckx S, Heuskin AC, Michiels C, Lucas S. Nanomaterials (Basel). 2019 Feb 19;9(2):295.
doi: 10.3390/nano9020295. PMID: 30791480 Free PMC article.
Radiation-induced synthetic lethality: combination of poly(ADP-ribose) polymerase and RAD51 inhibitors to sensitize cells to proton irradiation. Wéra AC, Lobbens A, Stoyanov M, Lucas S, Michiels C. Cell Cycle. 2019 Aug;18(15):1770-1783.
doi: 10.1080/15384101.2019.1632640. Epub 2019 Jun 25. PMID: 31238782 Free PMC article.
Gold nanoparticles affect the antioxidant status in selected normal human cells. Daems N, Penninckx S, Nelissen I, Van Hoecke K, Cardinaels T, Baatout S, Michiels C, Lucas S, Aerts A. Int J Nanomedicine. 2019 Jul 8;14:4991-5015.
doi: 10.2147/IJN.S203546. eCollection 2019. PMID: 31371943 Free PMC article.
Characterization of the role of TMEM45A in cancer cell sensitivity to cisplatin. Schmit K, Chen JW, Ayama-Canden S, Fransolet M, Finet L, Demazy C, D'Hondt L, Graux C, Michiels C. Cell Death Dis. 2019 Dec 4;10(12):919.
doi: 10.1038/s41419-019-2088-x. PMID: 31801939 Free PMC article.