 |
| 1. |
La première chose à retenir est que la
somme algébrique des étages d'oxydation
des éléments constitutifs d'une molécule
(ou d'un ion) est égale à sa charge électrique
nette.
|
| Cela veut
dire que si la molécule est neutre, la somme des
E.O. est égale à zéro, s'il s'agit
d'un ion, la somme est égale à la charge
de l'ion. |
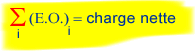 |
| |
Exemple :
|
 (E.O.) de H2SO4 = 0
(E.O.) de H2SO4 = 0 |
|
| |
|
 (E.O.) de SO4 -- = -2
(E.O.) de SO4 -- = -2 |
|
| 2. |
La
deuxième chose à retenir est l'E.O. de certains
éléments :
|
| |
 Les métaux
Les métaux |
E.O. =
+1 |
famille Ia
: Li, Na, K, Ag |
| |
|
E.O. =
+ 2 |
famille IIa
: Be, Mg, Ca, Ba, Zn |
| |
|
E.O. =
+ 3 |
famille IIIa
: B, Al |
| |
 L'hydrogène
L'hydrogène |
E.O. =
-1 |
dans un hydrure
(H-). ex . NaH |
| |
|
E.O. =
0 |
exclusivement
dans la molécule H2 |
| |
|
E.O. =
+1 |
à part
ces deux cas ci-dessus, l'hydrogène est toujours
à l'étage +1 |
| |
 L'oxygène
L'oxygène |
E.O. =
-2 |
presque toujours |
| E.O. =
-1 |
dans péroxyde
(-O-O-) : H2O2 |
| |
|
E.O. =
O |
exclusivement
dans la molécule O2 ou O3(Ozone) |
| |
 Le fluor
Le fluor |
E.O. =
-1 |
presque toujours |
| E.O. =
O |
exclusivement
dans la molécule F2 |
|
|
|