Optimisation d'une méthode de renaturation de protéines basée sur l’utilisation de nanoparticules.
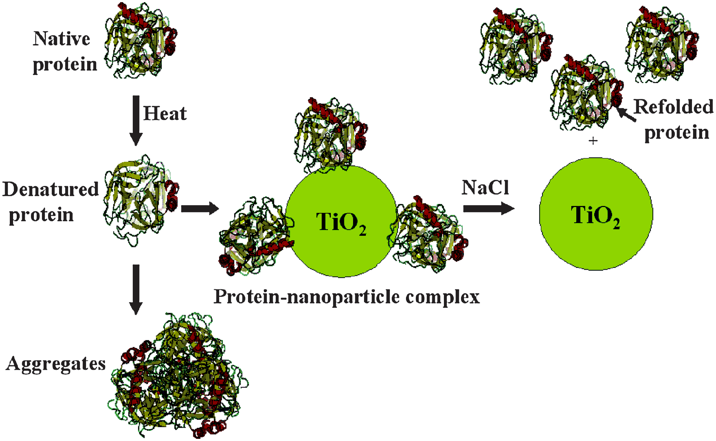
Figure provenant de: J. Mater. Chem., 2009, 19, 2830–2834
La compréhension des phénomènes de repliement des protéines est un défi majeur en biochimie car la structure tridimensionnelle d’une protéine à l’état natif lui confère souvent une fonction spécifique. De nombreuses protéines produites en laboratoire ou en industrie ne se trouvent pas dans leur état fonctionnel; elles forment en effet des agrégats biologiquement inactifs et sont donc non exploitables comme telles. A ce jour, il n’existe pas d’approche expérimentale universelle et performante favorisant un repliement optimal.
Dans ce cadre, une méthode originale, basée sur l’association du détergent SDS et d’un cosolvant, a été mise au point par notre groupe et semble pouvoir s’appliquer à plusieurs types de protéines. Par ailleurs, Il s’avère que de nombreuses études montrent que la fonction et la structure des protéines peuvent être modifiées à travers leur interaction avec des nanoparticules (NPs). Notamment la protéine GFP (Green Fluorescent Protein) a pu être renaturée à partir de NPs de ZnO; la conformation de plusieurs enzymes, comme l’anhydrase carbonique et la chymotrypsin, a pu être restaurée grâce à des NPs d’oxyde d’aluminium ou de dioxide de Titane.
Dans ce projet, nous aimerions combiner l’effet de divers types de NPs avec notre méthode de renaturation afin d’en améliorer son efficacité. La liaison de la protéine avec les NPs empêcherait son agrégation et donc faciliterait sa renaturation.
La liaison protéine-NPs sera d’abord évaluée par XPS, AFM, PM-IRRAS,…Ensuite, nous testerons l’efficacité de la renaturation par diverses méthodes spectroscopiques (fluorescence, dichroïsme circulaire, diffusion dynamique de la lumière).
Ce projet original et innovant ouvre de nombreuses perspectives dans les domaines biotechnologique, médical et industriel.
Mémoire en collaboration avec le laboratoire CES, Département Chimie









