Les isotopes sont des nucléides
d'un même élément
dont les noyaux possèdent
:
même
Z mais différents
A
|
| Exemple
: |
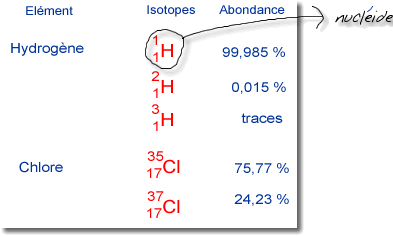
L'élément
chlore (Z=17) possède
2 isotopes :
le chlore 35 ayant 18 neutrons
et le chlore 37 ayant 20 neutrons.
|

|
 Autre exemple
Autre exemple |
le
12C, le 13C
et le 14C sont trois
isotopes du carbone, car ils
possèdent tous 6 protons.
Cependant, leurs nombres de
neutrons diffèrent le
12C en a 6, le 13C
en a 7, et le 14C
en a 8. |
 Naturels ou artificiels
Naturels ou artificiels |
Certains isotopes sont naturels,
ils ont été
produits dans la nature (par
exemple, les trois isotopes
du carbone mentionnés
ci-dessus), alors que d'autres
sont artificiels, ils
sont produits en laboratoire
ou en industrie (par exemple,
le 60Co, dont les
rayonnements sont utilisés
pour traiter certaines tumeurs
cancéreuses).
|
 Radioactivité
Radioactivité |
Certains
isotopes, naturels ou artificiels,
sont instables. Ils peuvent
alors se désintégrer
en émettant des rayonnements.
On dit alors qu'ils sont radioactifs.
Les isotopes radioactifs sont
parfois appelés radio-isotopes.
Par exemple, le 12C
et le 13C sont stables
alors que le 14C
est radioactif. |
 Abondance des isotopes :
Abondance des isotopes : |
L'élément
est souvent constitué
de plusieurs isotopes présents
dans diverses proportions nommées
abondance : |
 |
Les
nucléides = les
fruits
Les éléments
= la pomme, la poire, l'orange,
....
Les isotopes d'un élément
= jonagolg, boskoop, Granny
Smith ... de la pomme, |
| |
|
= williams, conférence,
... de la poire. |
|